L’acqua, dal punto di vista chimico, è, come dicevamo, una molecola, costituita da due elementi: l’idrogeno, il cui nome significa appunto “generatore di acqua” e l’ossigeno.
La sua struttura è tale per cui le sue proprietà chimico-fisiche sono praticamente uniche; molte di esse le conosciamo tutti: l’acqua solidifica a 0°C e passa allo stato di vapore a 100°C. Ma quello che non tutti sanno, o meglio quello che forse tutti sanno ma su cui nessuno si è mai soffermato abbastanza a lungo per poter rendersi conto della complessità del problema, è che l’acqua è anche un solvente.
In pratica l’acqua è in grado di solubilizzare moltissime sostanze, detti soluti.
Alcuni di essi sono dissociabili, come ad esempio il sale da cucina, l’NaCl, altri non lo sono, come ad esempio lo zucchero.
Un’altra particolarità importante è che la molecola dell’acqua si può scindere in ioni dando origine a reazioni di dissociazione del tipo
2 H2O = H3O+ + OH-
Questa equazione chimica mostra un segno algebrico di uguaglianza che separa i due membri; il segno di uguaglianza sta a significare che la reazione, così come è scritta, rappresenta un equilibrio chimico, cioè essa può essere letta sia da sinistra a destra che al contrario.
In pratica possiamo dire che nell’acqua si verificano due reazioni contemporanee in cui due molecole reagiscono tra loro per formare i due ioni scritti a destra, mentre contemporaneamente altri due ioni, uguali a quelli scritti a destra, reagiscono tra loro per formare due nuove molecole di acqua.
Queste reazioni sono in continuo divenire ed a un certo punto la velocità della prima uguaglierà quella della seconda: saremo quindi arrivati all’equilibrio.
Questo equilibrio può essere espresso matematicamente con una espressione, detta costante di equilibrio, il cui valore, una volta fissate temperatura e pressione, resta sempre lo stesso.
La conseguenza più importante di tutto questo è che all’equilibrio i due ioni H3O+ e OH- saranno in quantità uguali e quindi l’equazione qui sopra potrà essere scritta come:
[H3O+] · [OH-] = [H3O+]2 = 10-14 (costante di equilibrio)
da cui, calcolando la radice quadrata, si ottiene
[H3O+] = 10-7 mol/L
Questo valore è estremamente piccolo (corrisponde a 0,0000001); dato che i numeri in gioco possono variare anche di diversi ordini di grandezza, è più conveniente esprimerli come logaritmi decimali.
Quindi l’ultima equazione diventerà:
lg [H3O+] = lg 10-7
cioè lg [H3O+] = -7
che cambiato di segno diventa, all’equilibrio
– lg [H3O+] = 7
Definendo -lg [H3O+] come “pH”, ecco che abbiamo la più famosa espressione della concentrazione di ioni idrossonio, la specie acida dell’acqua.
|
In modo meno esatto ma uniformemente accettato, si può definire il ph all’equilibrio come – lg [H+] = 7 Cioè come la base esponenziale cambiata di segno della concentrazione di ioni H+. |
Come tutti sanno, i valori di pH inferiori a 7 (cioè con potenze di 10 tra 0 e -7) stanno ad indicare soluzioni acide, mentre i valori superiori a 7 (cioè con potenze di 10 tra -7 e -14) stanno ad indicare soluzioni alcaline.
Il significato è abbastanza ovvio: più la potenza di 10 diminuisce (in valore assoluto) più la concentrazioni di ioni idrossonio aumenta, e quindi aumenta l’acidità. Più la potenza di 10 aumenta (sempre in valore assoluto) più la concentrazioni di ioni idrossonio diminuisce, aumentando perciò la basicità delle soluzioni.
In generale possiamo dire che avremo soluzioni acide quando il valore di pH sarà compreso tra 0 e 7, mentre avremo soluzioni alcaline, o basiche, quando il valore di pH sarà compreso tra 7 e 14, anche se valori esterni a questo intervallo, invero non comuni, sono ammessi.
E’ necessario, infine, porre l’accento sulla conseguenza più importante che deriva dall’uso dei logaritmi: il passaggio di pH da una unità ad una immediatamente successiva, o precedente, comporta in realtà una variazione della concentrazione di ioni idrossonio pari a 10 volte.
Il simbolo “pH” fu introdotto nella letteratura chimica per indicare una grandezza atta a definire il grado di acidità o di basicità delle soluzioni dal biochimico danese Sörenson con una classica memoria pubblicata nel 1909 su un suo importante lavoro. Il biochimico danese stava studiando il problema della misura del grado di acidità dei liquidi di fermentazione, presso la fabbrica di birra Carlsberg di Copenaghen. La suddetta pubblicazione, con la prima definizione di pH e con la prima precisa descrizione del metodo di misura segnò l’inizio di una serie ininterrotta, di studi teorici e ricerche sperimentali che hanno portato al concetto odierno di ph e alle attuali tecniche di misura.
La scala dei valori pH va da O (molto acido) a 14 (molto alcalino). Il valore pH neutro è 7.
Tenendo presenti le caratteristiche di animali e piante presenti nelle acque si può affermare che
· valori di pH inferiori a 3 e superiori a 12 sono letali per tutte le specie viventi;
· valori di pH intorno a 4,5 e 9,5 sono adatti a pochi organismi altamente specializzati;
· valori di pH intorno a 6 sono adatti a piante ed animali delle foreste tropicali;
· valori di pH compresi tra 6 e 8 sono favorevoli alla vita della maggior parte di piante ed animali;
· valori di pH intorno a 8,5 sono adatti a poche specie di acqua dolce e alle specie marine.
Come si forma acqua acida o alcalina:
Il valore pH dell’acqua piovana si aggira normalmente intorno a valori inferiori a pH 5, spesso anche 3,5 – perciò decisamente acido.
Se quest’acqua piovana attraversa strati di terreno ricchi di humus o addirittura di torba si acidifica ulteriormente con acidi umici. L’acqua estratta dal pozzo ha poi un valore di durezza basso ma è decisamente acida. Se quest’acqua piovana attraversa terreni calcarei gli acidi vengono neutralizzati. L’acqua diventa dura ed ha una reazione alcalina.
Va tenuto presente che con forti piogge (oltre i 15 minuti), anche in zone lontane dalle città, entra nei bacini d’acqua una grande quantità di acqua con un valore pH molto acido, fino a pH 3,5.
Il ph dell’acqua può essere controllato in diversi modi; il più comune ed economico è il metodo colorimetrico che prevede l’uso di soluzioni di coloranti. Questo sistema è rapido, sufficientemente accurato ed ha una risoluzione di circa 0,2 unità di pH. Simile ad esso è il metodo colorimetrico che prevede l’uso delle cartine indicatrici. Per valori più accurati e precisi si possono usare i pHmetri elettronici, sia portatili che da banco. I primi sono più economici, anche se la loro risoluzione non è molto più alta di quella fornita dalle cartine o dai test colorimetrici, essendo pari a circa 0,1 unità di pH. I secondi sono i più precisi ed accurati in assoluto, fornendo valori con risoluzione anche di 0,005 unità di pH; il loro costo però ne sconsiglia l’uso amatoriale.
Una volta determinato il valore di pH, esso può essere modificato, se ritenuto non idoneo, con i cosiddetti correttori di pH.
Non si tratta d’altro che di acidi o basi che vengono aggiunti all’acqua. I correttori più comunemente usati per abbassare il pH sono l’acido cloridrico (HCl) e l’acido solforico (H3SO4). Il primo ha il vantaggio di non avere effetti collaterali sgraditi ma è scarsamente controllabile in quanto è un acido forte. C’è quindi il rischio di perdere il controllo del pH e di portarlo troppo in basso, provocando un danno maggiore di quello a cui si voleva porre rimedio. Il secondo è più facilmente dosabile ma è più pericoloso da maneggiare, poiché sviluppa una notevole quantità di calore a contatto con acqua. Entrambi, tuttavia, non eliminano le cause che hanno portato ad un innalzamento del pH ed una volta cessato il loro effetto, il pH tornerà ai valori iniziali.
Aspetti pratici legati al Ph dell’acqua di piscina:
Nel caso particolare dell’acqua di piscina, va detto che variazioni del ph avvengono regolarmente a seconda di alcuni fattori che andremo ad analizzare, e che devono essere messi in opera accorgimenti per riportare il ph ai valori più indicati.
Ma qual è il valore di ph più indicato per l’acqua di piscina?
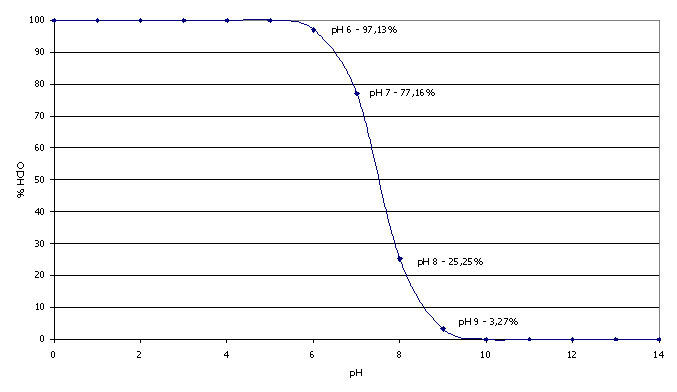
Vediamo sotto riportato un grafico che illustra l’andamento dell’acido ipocloroso in percentuale (HClO %) in funzione del ph.L’acido ipocloroso è il vero agente disinfettante che viene prodotto come reazione chimica da tutti i prodotti a base di cloro utilizzati in piscina indipendentemente dal nome e dall’aspetto del prodotto (liquido, in polvere o in pastiglie).
|
Come si vede dal grafico, il massimo dell’idrolisi dell’acido ipocloroso si ha con ph 5, mentre la percentuale scende fino ad arrivare a 0 con ph 9. Il miglior compromesso tra la massima efficacia possibile del cloro utilizzato ed un ph non aggressivo per l’epidermide e le tubazioni dell’impianto si trova a mio parere in un intervallo tra 7.0 e 7.2 .
|
Va innanzitutto tenuto presente il ph dell’acqua di riempimento, che può andare in teoria da un minimo di 5 ad un massimo di 8.5, anche se in pratica il valore minimo difficilmente scende sotto 6.5.
Già dopo il riempimento della vasca, quindi, in genere si presenta la necessità di “sistemare” il valore di ph.
Inoltre l’inquinamento apportato dai bagnanti tende in genere ad alzare il valore, così come fa, in misura molto maggiore, l’introduzione in acqua di ipoclorito di sodio.
I prodotti a base di acido cianurico, di cloro e tricloro isocianurato, invece, tendono ad abbassare il valore sotto 7.0 .
Da qui deriva la necessità di introdurre nell’acqua sostanze per abbassare od alzare il valore del ph.
Come già detto precedentemente, per abbassare il ph è necessario utilizzare prodotti a base acida, mentre per alzarlo si usano prodotti alcalini.
In genere in piscina si usano prodotti a base di acido cloridrico (acido molto forte) o solforico (meno potente ma con il vantaggio di non contribuire alla formazione di cloruri) e prodotti alcalini in genere a base di soda. La soda caustica, che costa pochissimo e si trova in tutti i consorzi agrari, è un prodotto molto usato per innalzare il ph delle piscine.
Mantenere corretto e costante il valore del ph è un aspetto molto importante della conduzione dal punto di vista chimico della piscina, poiché un corretto valore favorisce di molto l’azione del disinfettante ed inibisce la formazione di alghe e di calcare.
Inoltre, un valore corretto di ph contribuisce a mantenere un corretto bilanciamento chimico dell’acqua, di cui parleremo in seguito.