Prima la pratica
Comunque sia, la piscina verrà disinfettata con cloro gas e/o ipoclorito di sodio, prodotto questo ultimo ben diverso dalla soluzione a base di ipoclorito che si trova in commercio, poiché molto più puro.
La differenza rispetto ai metodi tradizionali è comunque enorme, poiché non c’è più la necessità di stoccaggio e di trasporto dei prodotti chimici, con tutti i problemi legati alla sicurezza, e soprattutto non inseriamo più nell’acqua composti a base di cloro, ma cloro gas e ipoclorito puri, che formeranno semplicemente acido ipocloroso e nulla altro. Niente acido cianurico, niente soda (quando si produce ipoclorito o quando si utilizzano macchinari con membrana selettiva, come vedremo dopo), niente titolo che cala e niente “schifezze” di vario genere che dal cloro cinese in poi purtroppo siamo abituati a vedere.
Si riformerà solamente il cloruro che si forma quando viene introdotto ipoclorito di sodio nell’acqua, ma non di più.
Poi, un po’ di teoria
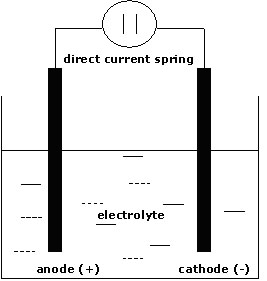
Il sale da cucina è formato da molecole di cloruro di sodio (NaCl). L’acqua non si limita a sciogliere le molecole del sale, separandole l’una dall’altra, ma divide anche ogni molecola nei due atomi che le costituiscono. Però, dal momento che il sodio possiede un elettrone debolmente legato, mentre il cloro lo attira fortemente per completare la corteccia elettronica esterna, il sodio cede stabilmente l’elettrone al cloro. In questo modo, il sodio diventa elettricamente positivo e il cloro negativo. Essi sono diventati degli ioni.
Le molecole di sali, acidi e basi sciolti in acqua, ionizzano, si dissociano cioè in particelle di carica opposta. Sono proprio gli ioni che rendono l’acqua conduttrice. Infatti, gli ioni positivi vengono richiamati dall’elettrodo negativo e viceversa. Nel nostro esperimento, gli ioni Na+ e Cl– hanno reso conduttrice l’acqua distillata. Una soluzione conduttrice si definisce anche elettrolita. Non solo l’acqua, ma anche altri liquidi sono capaci di ionizzare sostanze che vengono poste in soluzione.
Il processo di reazioni elettro-chimiche prodotte nella vasca dal sistema di elettrolisi del sale si può definire con le seguenti espressioni chimiche:
2NaCl + 2 H2O = 2NaOH + H2 +Cl2
sale+acqua = soda+idrogeno+cloro
In presenza di sodio disciolto in acqua è presente anche la formazione di ipoclorito di sodio secondo la reazione:
NaCl + H2O = NaClO + 2H
sale+acqua = sodio ipoclorito + idrogeno
L’elettrolisi con il sale nell’acqua della piscina
Il metodo attualmente più utilizzato è quello di salare direttamente l’acqua della piscina, con una concentrazione di 3-6 grammi di sale per litro di acqua, circa il triplo di quella dell’acqua dolce e molto inferiore a quella dell’acqua di mare che si aggira tra i 20 e i 30 gr/lt.
L’utilizzo di sostanze per abbassare il pH è inoltre necessario, come nel caso di impiego di ipoclorito di sodio aggiunto all’acqua e in considerazione del fatto che viene prodotta anche una certa quantità di soda, sostanza a pH molto elevato.
La regolazione della clorazione con questa tipologia di apparecchiature avviene in fase di fornitura dell’apparecchio (si sceglie l’apparecchio più adatto in base al consumo di cloro) mentre durante la conduzione la regolazione avviene con un sistema on/off, nel senso che si programmano le ore di attività.
L’elettrolisi con il sale nel serbatoio
Una soluzione alternativa è quella di utilizzare impianti dotati di una speciale membrana in grado di mantenere separati gli ioni Na+ e Cl-, formando quindi esclusivamente cloro gas che viene disciolto in acqua prima di arrivare in vasca formando immediatamente acido ipocloroso mentre la soda viene trattenuta ed eliminata a parte.
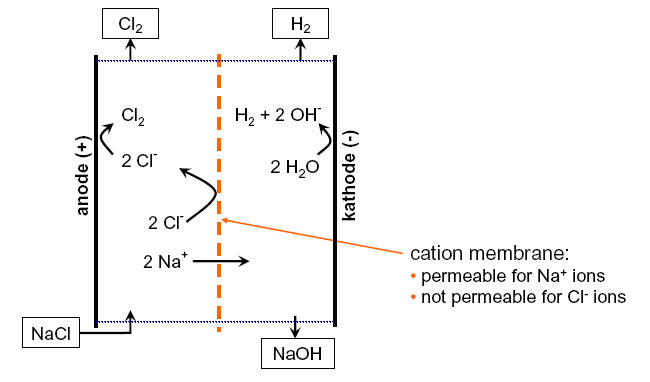
Immagine fornita da Prominent Italiana srl
Inoltre in questi impianti il sale non viene disciolto nell’acqua della vasca ma viene utilizzato dalla macchina prelevandolo da un serbatoio simile a quello di un addolcitore.
In questo caso la produzione di cloro può essere regolata anche elettronicamente, poiché è possibile modificare la quantità di sale da prelevare dal serbatoio per l’elettrolisi.
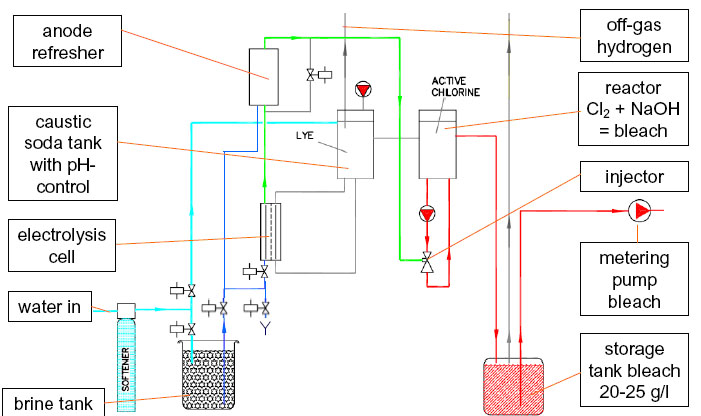
Immagine fornita da Prominent Italiana srl
La regolazione del cloro prodotto
Inoltre tutto il sistema deve essere dimensionato per questi carichi di picco e risulterebbe sovradimensionato per la conduzione ordinaria.
Come abbiamo già visto, con le apparecchiature più semplici semplicemente si spegne la cella se la concentrazione di cloro è troppo elevata.
Quale sia la necessaria portata è quindi in relazione al consumo di cloro, che è determinato in massima parte dal numero di bagnanti e dal sole.










